|
近年來,由於同步輻射光源所產生X光的優異性能,X光顯微成像在解析度、影像對比與品質方面有突破性的進展。X光成像術 (radiology) 是X光應用最廣的領域。因此同步光源的高空間同調性應用在創新的超高解析度X光顯微術時,其結果特別地引人注目。利用小劑量的X射線輻射即可獲得的高品質的X光顯微影像和動態影片。這些技術除了在傳統的材料科學的研究分析外,已經在生物學和醫學研究方面上產生了重要的應用。本文將詳細探討全影像是的兩種X光顯微技術並以數個生醫樣品的成像為例,說明X光成像的發展與展望。
一、前言
自從倫琴 一百多年前(Rontgen) 發現X光以來 [1],X光成像術 (radiology) 即是這種神奇的電磁輻射線最廣泛的應用。其中診斷用的X光顯微術更是醫學發展的一個里程碑。X光最重要的也是最吸引人的特性就是與其他之前所知道的電磁波相比起來極高的穿透性能,使人類第一次能夠在不破壞、不侵入的狀況下看到人體內部的許多重要的器官與結構。也因如此它改變了傳統醫學的診斷模式,使醫生能對許多症狀判斷不再侷限於單純外表病徵觀察的來推測病情,而是演進到可以利用可靠的影像資訊建立的更完整的分析。這對醫學的貢獻可以說是革命性的,而且一直延續了一百年到現在,X光仍是醫院中最重要的診斷工具。
除了X光的高穿透能力外,相對於大多數常用的光源來說,其波長極短,理論上說其影像解析度應不會受『繞射極限』(diffraction limit)的影響,因此一直不斷的有科學家嘗試提高X光成像的解析度,進一步希望使用它來進行顯微術。以生物醫學而言,所有的研究都是希望能對活的生物體進行觀察,對研究對象不加以破壞的需求也因此比其他的科學研究高的多。此外我們又希望不但能觀察器官,更能進一步觀察更小的組織、細胞、胞器、甚至DNA與蛋白質。如果我們將可以利用X光進行高解析度的顯微術,那麼我們有可能可以看到物體的內部比光學顯微鏡可以看到的還要細微的結構,這將是生物醫學上非常有用的工具。
可惜幾十年以來,影像科技雖有極大的進展,但是受到X光光源品質的限制,到目前為止,傳統醫用的X光成像技術的效能,和一百年前倫琴發現X光時所進行的X光成像,在解析度上可以說並無太大的不同。近年主要是基於同步輻射光源的發展,X光的光源物理性質已有相當的進展,在研究領域,X光顯微術的性能,已大幅改觀[2-15]。譬如說因為X光的空間同調性(spatial coherence)已得到初步實現[2、5],也使得在X光顯微術中同調性的影響變得極為重要。這些X光顯微術目前雖然大部分建立在同步輻射光源的優異性能,但是並不影響其快速成長、並迅速擴展其應用到不同的領域。所造成的影響也從初步小規模的技術研究與發展,到現在已經開始在不同的領域裡產生了重要的研究結果[2-15]。這樣的發展對材料科學和生物學來說是有其特別的重要性 (例如,對材料動態的高解析度、非破壞性分析及單一細胞的X光影像等) [16],而在醫學上的應用遠景更是令人鼓舞 [2,3]。
我們將會討論X光顯微成像技術這個領域發展的兩種對生醫研究特別有潛力的成像方式,並且介紹在生物醫學中我們已獲得的一些結果。本文將希望藉由回顧這個領域的發展和近年的研究成果,配合同步輻射X光顯微術概念及其理論背景的討論[3],使讀者能夠體會這項技術未來應用的無限潛力。
二、原理及技術背景
1. X光顯微成像原理
各種類型的X光顯微術都是基於光子與凝聚態物質(軟的或硬的)之間相互作用的不同作為期成像的機制。本文所要介紹的兩種全景穿透式X光顯微術其取像方式都基於相同的原理:讓X光子束進入並穿透目標物體後,然後由兩維探測儀器來接收穿過樣品後的X光。兩種顯微技術唯一的差異在於其對穿透物體後(在轉換成可見光影像前)是否對X光影像進一步放大。如欲取得高於光學顯微技術的解析度,適當的X光光學元件能夠對X光影像作精確的放大,是唯一可行的方式。
因為樣品的內部各部分對X光光子之作用不同(受到其複數折射係數的控制)造成穿過樣品後X光在垂直光進行方向平面的分佈有所變化,分析這些變化可了解樣品各部複數折射係數的分佈進而了解物體內部的細微結構。從理論上說,複數折射係數的實數部(也就是相位)和虛數部(吸收)在這一機制中都有作用[4]。然而在實際情形中,除非X光束具備高同調性,否則折射係數的實數部的影響並不明顯[2, 4]。例如標準醫用X射線儀的光源多半來自典型的使用高壓電子束轟擊金屬陽極板所產生,因其波長範圍寬,光源尺寸大,光束發散,因而都不具備同調特質。因此在標準的X光成像技術中,通常無法利用相位成像的效應。事實上迄今為止,所有的醫用X射線診斷儀都是根據樣品不同部位間對X射線吸收的差異所造成的影像對比來進行成像的。
2. 同步輻射X光的同調性
同調性一般是指是當一個輻射源的波長(光子能量)被限制在一個極小的範圍內,並且光源的尺寸和角發散性足夠小[2, 4],干涉和繞射現象可被觀察到時的一個特性指標。根據此一概念導引,我們可以區分兩種不同的同調性,縱向(longitudinal或稱為時間, temporal)同調性及橫向(lateral或空間, spatial)同調性。
高時間同調和高空間同調性都與波長有決定性之關聯,當波長變小時較難達到高時間同調和高空間同調。也因此可以理解為何X光比可見光或紅外光更難達到同調的特性。傳統的X光源同調性極差的另一個原因是因為它們的光源尺寸,發散角和頻寬都非常大。值得注意的是,非同調的光源是可以提高同調性的。例如寬頻光源可以籍由單光器過濾的方法來減小頻寬。另外縮小光源的大小,例如使用帶有針孔的遮蔽物,將其置於遠離發散的傳統光源處,這樣小孔就變為具有空間同調的二次光源。但是由於這些方法只利用到小部分的光子強度,雖然可以提高同調性但是會造成光源強度太弱,以致很難有實際的用途。
同步輻射光源因其高準直、低度發散的光源特性,其自然的輻射已具備了相當高的空間同調性。此外使用所謂的插件元件(insertion device),同步輻射光源通過增頻(wiggler)或聚頻(undulator)磁鐵的控制從一個小點發出一道準確的平行光束,可更大幅提高空間同調性。至於時間同調性,通過聚頻磁鐵同步輻射可以提供了一道相當窄頻寬的光束,因此產生了時間同調性。另外也可以用單光鏡過濾掉發散輻射來增加時間同調性。由偏轉(bending)和增頻磁鐵發出的X光其同調程度已足夠滿足大部分的應用。若有需要則可以進一步用單光器來增加時間同調性。
為瞭解利用相位差異成像的方法,我們採用非常簡單的成像機制的圖片加以說明。如圖一(a) 所示,我們可以發現物體的邊緣因為不同的折射係數而產生明顯的一系列繞射條紋。這些條紋讓人聯想起由菲涅爾繞射(Fresnel diffraction)在不透明物體邊緣所產生的繞射條紋。這兩個現象的確很相似[14] ,唯一的區別只是在於:對X光而言,沒有所謂的不透明物體,只是不同區域有不同的折射係數而已。但整體而言,其結果就如圖一(a)中的菲涅爾繞射條紋一樣 [14]。
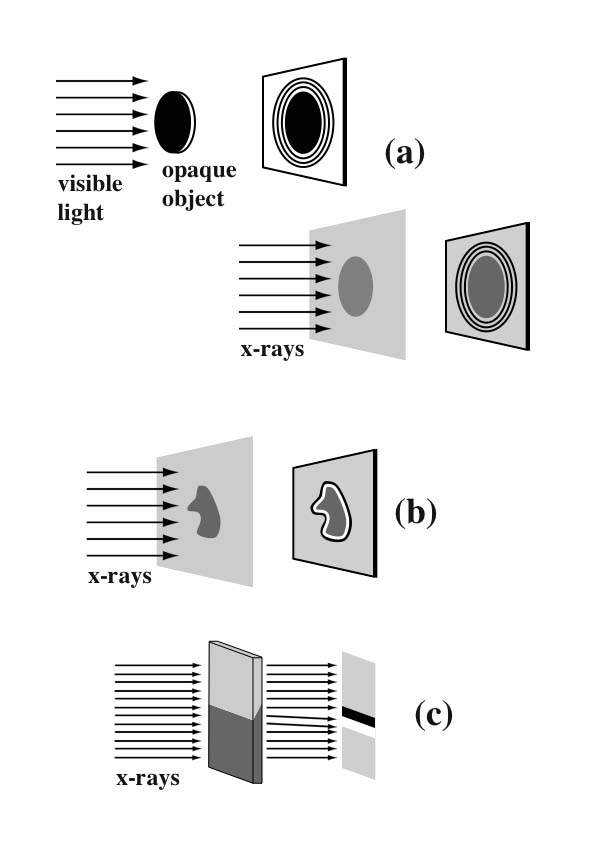
圖一(b)的結果和圖一(a)既有相似又有不同。我們仍可看到邊緣加強效應。然而,一系列繞射條紋被較寬明暗相間的條紋所取代。其實造成這現象的原因可以用一個比較簡單與折射現象類比的方式來解釋。圖一(c)表示了傾斜的邊緣所產生的折射可以造成明暗相間的條紋。其他形狀的邊緣也可以產生類似現象。

圖二是以一根光纖當作樣品所取得的影像,顯示出了繞射與折射成像的轉變過程[15],兩者主要的差異在於物體和偵測器的距離,只要改變這項參數就可以選擇加強繞射或折射機制。雖然含有繞射信號的成像包含較多的訊息(類似全像術),但折射現象的觀察則較為簡單且容易瞭解[15]。而且在同調X光顯微影像的實際應用上,利用邊緣折射成像的機制較容易達成,只要調整物體與偵測器就可以實現。
圖二所顯示的折射與繞射之間的交互作用可以與產生側向與縱向的同調性的條件一併探討和解釋。此方法的細節在參考文獻之14與15有詳細的討論。從這些討論中,我們可以發現顯示時間同調性的條件非常容易滿足,幾乎所有的同步輻射光源即使不加單光器也能符合所需條件[5]。空間同調性也是相當微弱的條件,大部分的同步輻射光源皆符合此要求[4, 5]。此外另一個限制條件就是物體與偵測器之間的距離必須大到足夠讓偵測器的側向解析度偵測到繞射條紋。換句話說,如果偵測器和物體的距離太短,就無法觀測到條紋。但是,如果距離太大,則折射所產生的明暗條紋又會重疊在一起以至於模糊的看不見。也就是說,折射機制只在某一段有限的物體-偵測器距離內才有效。
我們現在可以總結折射與繞射的交互作用如下:如果物體和偵測器之間的距離很短,則不會有邊緣加強效應,影像對比完全取決於吸收對比。隨著物體-偵測器距離的增加,折射條紋開始出現。當隨著物體-偵測器距離的進一步增加,繞射條紋開始出現而折射條紋則逐漸淡出。
從這個角度來說,同步輻射光源的出現正從三方面深刻地影響著X光顯微術技術的發展[2, 3, 5]。首先,即使我們忽略由非X光吸收機制所引起的效應,同步輻射光源的高強度和準直性對於提高標準的X光顯微術已經多有裨益。[5] 其次,利用X光吸收與入射X光能量的相關性,同步輻射光源提供的單色X光束可以提高X光顯微術技術的效能[3, 5]。一般的X光源強度都很弱,從中獲取的單色光的強度,更無法有效用於X光顯微術。同步輻射X光不僅單色性好而且光強度比傳統光源高數千倍。第三,由於同步輻射X光具有高同調性的特點,這使得我們可以同時利用複數折射係數的實數部和虛數部所造成的效應來進行X光顯微術。
2. 利用波帶片成像的超高解析度全景X光顯微術
在目前在生物及生物醫學領域中,發展超過光學顯微解析度的新式顯微術是一個極為重要的方向,而能夠偵測到個別細胞甚至其細胞內的結構無疑是最重要的目標。X光雖然在最近一世紀的生物醫學研究中在扮演了基礎且重要的角色,但直到目前為止,在這個方向並無可觀之貢獻。在我們不斷的努力研究下, 利用同步輻射的全景X光顯微鏡觀察組織檢體,已經可以觀察到組織內之細胞內部結構。
我們的策略是希望能夠同時改進影像空間解析度與其影像對比。為了達到此目標,高亮度的同步輻射光源是無可取代的。由於同步輻射光源具有高同調性,利用此特殊的性質將能夠使影像解析度大幅提升[17-20],同時亦將能改進所獲得的影像對比,此乃主要基於折射係數實數部的貢獻(決定波的相位)[17,18] 而非虛數部的貢獻(吸收的衰減),利用此機制,預期可大幅增強軟組織與生物試片間之對比。
我們的實驗主要是利用短波長(~1 A)之X光(硬X光)的特性來穿透較厚的生物檢體。相對地,過去的X光顯微術乃利用長波長之軟X光(23~45 A)來當作光源,在此長波長之X光能量範圍內稱為水窗波段(water window),若在含有碳或水的試片中,利用軟X光觀察試片將可獲得最強之對比[21,22]。因此若搭配使用先進之軟X光光學元件,次細胞結構可在含有水氣之環境中觀察得到[23-25] 。然而軟X光並無法穿透較厚之生物檢體,最多只能夠穿透數層細胞而已,因此無法觀察到相對較厚的組織內部細胞結構,也喪失了使用X光最原始的目的。
若利用硬X光光源來觀察未經染色處理之組織內部細胞(組織厚度為數個微米),如果使用毫米解析度的X光顯微技術[16],的確無法達到次細胞解析度。但經由我們不斷的創新及改進,目前本實驗室所獲得的影像解析度已能達到預期之目標,即可觀察到組織內部細胞。最主的原因是因為我們使用本實驗室製作之菲涅爾波帶片來放大X光影像[26-28]。菲涅爾波帶片之製作乃基於本實驗室領先於世界之奈米製程技術[29],使用此波帶片,X光影像可達到小於30奈米[30]之空間(Rayleigh)解析度,同時影像擷取時間亦可小於50 ms。
我們亦利用染色方式標定與偵測在細胞內部特定的蛋白質,若能了解細胞內部的特徵,便能對次細胞結構(胞器)有更深入的了解。相對於其他顯微技術,如可見光、共軛焦螢光顯微鏡、穿透式電子顯微鏡等,硬X光顯微術中,對於細胞或胞器之染色,目前仍尚在摸索階段。目前我們只能使用基於傳統免疫染色的染色標定方式來增強目標物對X光吸收之對比,而尚無法充分利用相對比。即便如此,使用此技術已能更進一步探討具奈米解析度的特定蛋白質在二維甚至是三維中的空間分布。
相對於軟X光顯微術,使用硬X光顯微術具有一些顯著的優勢。其中一項為具有較深的試片穿透深度。當試片厚度大於5 mm時,目前我們仍然可以清楚地觀察到細胞內的資訊,且其影像空間解析度亦不會隨著試片厚度的增加而有明顯的損失。在先前的影像測試中[31-33],對X光繞射影像使用相位補償可達到奈米等級的解析度,相對的在我們的影像測試中,實驗結果顯示我們不需用任何影像處理就能夠達到次細胞等級的解析度。此外我們也曾利用相位補償方式對未經染色之細胞做影像測試,經由相位補償影像處理(基於波傳遞演算法[34,35])能夠在次細胞等級中產生相位分離(separate phase)與幅度圖像(amplitude images)。
我們目前正致力研發在奈米尺度中更具功能性的標定方式,以及更具功能性的聚焦元件、影像擷取及影像處理等。目前我們使用X光聚焦元件之波帶片可獲得小於30 nm空間解析度。然而此影像解析度仍然遠低於經由繞射極限所計算出的解析度極限,以及從使用之儀器設備所推估之解析度極限。使用經由奈米製程製作出高性能波帶片,由於其具有較小之最外圈線寬,因此可得到較佳之側向解析度,目前本實驗室已經製備出最外圈線寬小於25 nm的波帶片(如圖三)。 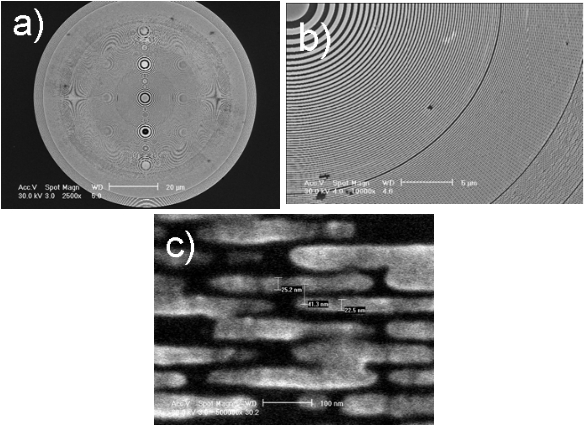
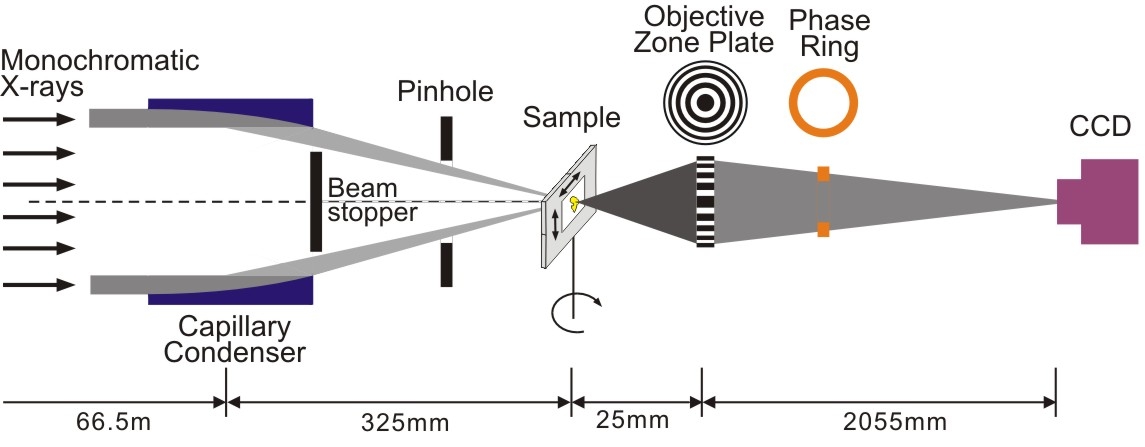
圖四為此X光顯微鏡的光學組成的示意圖。新一代的同步輻射光源由於X光亮度(brightness)可明顯提升,因此曝光時間將可大幅縮減,進而減低因活體試片在曝光時之瞬間移動而產生不必要的干擾。更進一步,若能使用高階繞射模型[36,37],雖然此模型所產生之訊號強度相對較弱而造成影像擷取所需時間將勢必增加,然而影像側向解析度可大幅提升。
三. X光成像實驗設施
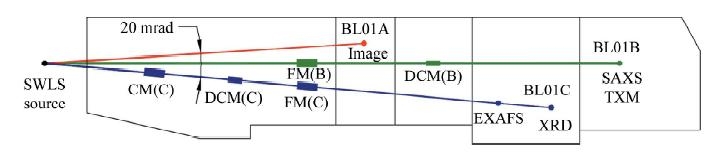
圖五顯示的是位於新竹同步輻射研究中心光源的X光顯微鏡光束線(BL01A)的略圖。這一條光束線的光源來自於一個超導移頻磁鐵(superconducting wavelength shifter, SWLS),為三個實驗站中的一條,可有效地將光子能量提高至較高能區域,主要的光子能量起始於4KeV,向上延伸至約40KeV。波帶片全景X光顯微鏡使用此三條光束線的另外一條。儲存環中的電子束大小在垂直與水平方線分別為12微米及120微米。BL01A光束線的全長為18.6公尺,光子的通量為1 x 1012 photons/sec。
實驗站中的樣品台具有六軸的自由度(精確度為0.1微米),外加旋轉及傾斜功能以配合諸如X光斷層掃描成像術或是其他需求。樣品離偵測器的距離,可由滑軌來控制,可調範圍為0.5毫米至1.5公尺之遠。X光穿過物體之後,由閃爍計數晶片(scintillator)轉換成可見光,再經CCD相機加以紀錄。閃爍計數晶片的材質為250微米厚的CdWO4單晶晶片,尺寸有10x10及30x30毫米見方兩種,視需要而更換。CdWO4的優點是具有較高的光轉換效率以及適當的解析度,而且非常能抵抗輻射損傷,適合長時間使用。在閃爍計數晶片上形成的影像,先經過光學顯微鏡頭放大之後,再由CCD相機加以擷取。光學顯微鏡頭是可拆換的,倍率介於1至50倍之間,視實驗需求而更換適當的鏡頭。CCD相機部份,亦有數種可供選擇,可供高速連續攝影(曝光時間短於0.1毫秒)或是長時間曝光使用。相機的畫素及灰階最大可至2000x2000畫素及16位元灰階。
目前本設施的整體性能,如小於1微米的空間解析度、小於1毫秒的時間解析度,以及波帶片X光顯微鏡的30奈米的解析度,已使它成為相當具競爭力的顯微技術。而X光獨特的穿透力,使我們得以觀察高於解析度104次方倍的厚樣品 (例如以1微米的解析度來觀察細胞,在厚達0.5公分的組織切片中仍可利用電腦斷層掃描方式重組出細胞結構)。其在影像上的卓越區分性及靈敏度(>1012 in volume) 正可以補足其他電子顯微鏡或是光學顯微技術的缺點,尤其當研究三維的微觀組織時,高解析度相對比X光顯微術將是最佳選擇。
四、生物學及醫學應用
1. 生物學
能將顯像技術推進至細胞的層級對於X光顯微成像術能否在生命科學方面有效應用的一個關鍵性挑戰。因為X光能量在284~543eV區間的能量範圍內,含碳區域與水的相對比可以達到最大值[22, 23],所以選擇這個能量區間X光顯微術的,已可以在含水的狀態下觀察次細胞的結構 [23-25]。然而,這個能量的X光光子最多只能穿透厚度超過幾μm(大約是一個單一細胞厚度),因此在某方面來說限制了該項技術的應用潛力。
同調X光顯微術由於利用折射率不同而造成的邊緣加強效應,細胞影像可以藉由硬X光而非軟X光取得。利用此方式,可以在更真實的環境下來研究厚樣品內微結構的三度空間分析。我們成功地採用此方法[16],不需要藉由任何染色或是增強對比的樣品製備程序,而直接觀察到細胞和次細胞等級的細微結構。例如我們發現對於5mm厚的樣品,從試片表面到指定的深度的細胞結構,在不需要犧牲空間解析度的情況下,仍然可以被清楚地被識別。我們最近的後續實驗更證明短波長的硬X光能用於獲得25-60nm解析度的影像重建,這已大大超出基於繞射成像的光學顯微鏡的解析度[31]。
藉由我們的方法可以相當簡單地獲得植物細胞的影像。圖六顯示的是在寬頻白光條件下孤挺花葉子的X光顯微影像的例子[16]。本圖的水平視野(Field of View, FOV)約為1.5毫米。要製備可以觀察的動物細胞也並不困難[3]。圖七所示為人工培養且被固定住的老鼠腦部的神經元細胞。不僅神經元軀體可以輕易的被觀察到,互相連結的神經細胞軸突也可以被觀察到。

圖六
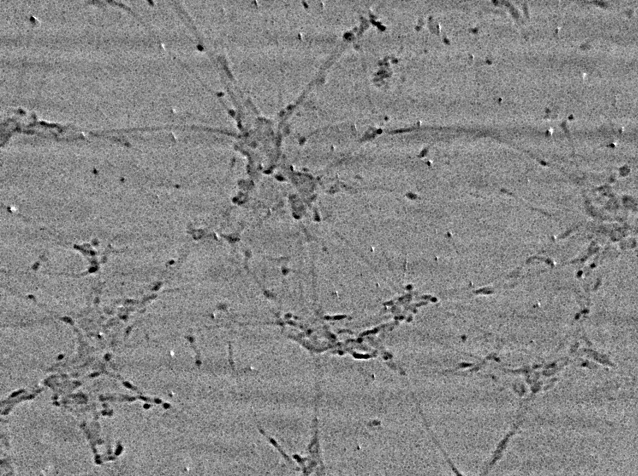
圖七
我們的結果顯示利用調X光顯微成像技術,可以在無染色的情形下,獲得清晰的細胞和次細胞等級影像。從獨特性、適用性、與未來改進潛力方面考量,我們的方法和其他的技術相較都較為優異。目前獲得的解析度大致和光學顯微技術相同,並且還可以有很大的改進空間。軟X光顯微成像技術雖然擁有略佳的解析度,但卻沒有辦法觀察厚度大於單層細胞厚度的樣品。穿透式和掃描式電子顯微鏡需要特定的樣品準備程式,並且樣品的厚度同樣不能太厚。而我們方法的優異處在於,利用硬X光的高穿透力,因此能容易地在保持樣品的自然狀態下觀察動物的整體內部結構及狀態。事實上,目前尚沒有一種顯微技術可以像同調X光顯微術技術一樣,可以以類似的高的解析度觀察厚試片 [16] 。
次細胞解析度實驗

圖八與圖九為使用硬X光波帶片穿透式全景顯微鏡所獲得測試結果,透過上述的雷利準則(Rayleigh-criterion)計算其空間解析度優於30 nm。圖八為西門子公司所生產的,標準氮化矽薄膜上製作的金星狀圖案測試片,最小線寬為30 nm而不同線寬的間距為60 nm。圖九是本實驗室製作的測試圖案,最小線寬為20 nm。我們可以發現小於20 nm的特徵也清晰可見。透過詳細分析(相似於參考文獻18)可以知道Rayleigh解析度為29 nm。
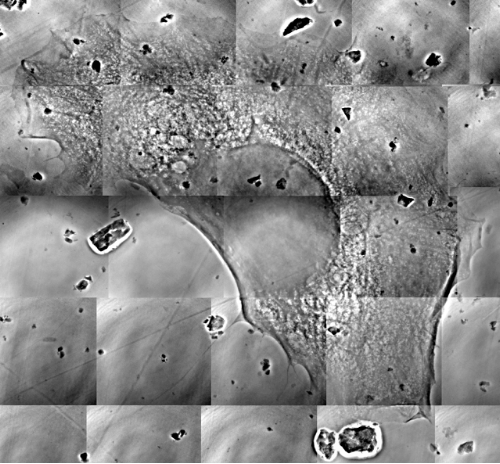
圖十為使用非單光X光高解析度,硬X光顯微鏡影像測試的進展。在圖十A中,利用非單光X光顯微術,藉由使用鎳增強效果的DAB染色,可以清楚地觀察到HeLa 細胞內網狀分布的相對比影像。其一微米的空間解析度近似於一般光學顯微鏡。我們可以清楚地看到在細胞中染色後的細胞骨架(Vitemntin)和細胞核(FOV = 240 μm)。細胞核不會被染色過程所影響並且有較弱的吸收對比。相較於細胞核,細胞質有較深的對比,因為它具有較緻密的細胞骨架染色,透過光學顯微鏡佐證可以發現,尤其是位於細胞質周圍的區域會有明顯地X光吸收。
在圖十中,明白指出結合波帶片之硬X光顯微鏡其放大倍率可以超越光學顯微鏡的限制。圖十中,我們可以清楚看到靠近細胞核成束的細胞骨架結構。細胞骨架也在靠近細胞質周圍呈現類似網狀物的結構,細胞邊界可以藉此完整顯現出清晰的輪廓。除了成束的細胞骨架外,也可以看到單一的細絲(filaments)。
X-光斷層掃描影像顯微術
對於數千張影像資訊的X光影像重建,快速的影像擷取是相當重要。同樣的,空間和時間解析度的妥協也是要被考慮進來。對那些培養細胞的檢體,平坦在培養皿表面上的結構,也會干擾到360度旋轉的影像擷取範圍,和部分角度受限到局部斷層掃描,使得影像資訊損失。

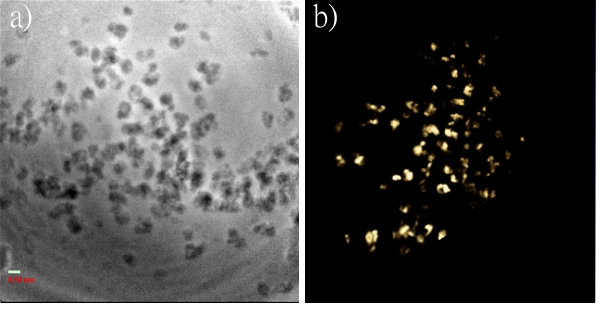
圖十一是EMT-6細胞經過免疫染色的測試結果,很清楚可以看到這個方法可以重現細胞骨架的三維立體結構,圖十一b)是圖十一a)的X光斷層掃描重建的影像。
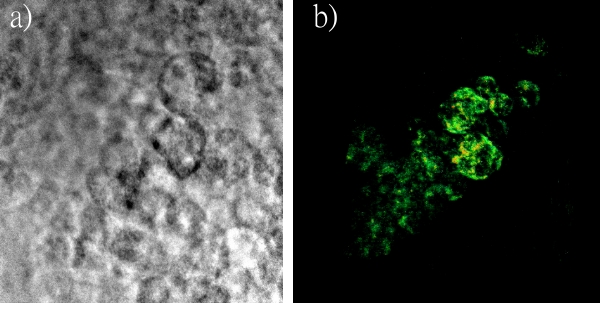
圖十二是同樣檢體的有限角度的影像重組,與奈米金粒子一起培養的EMT-6細胞。如圖十二a)和十二b)所示,細胞核附近叢集的金粒子可以被個別的解析出來。因此,即使是有限角度的局部影像重組,也不會造成空間解析度的惡化。
偵測奈米粒子的能力對於組織層的影像尤其重要,金奈米粒子可以清楚地在器官的組織層被偵測到,像是肝、腎和脾的靜脈末梢,圖十三是被放置在細胞膜上的200 μm厚的含有奈米金的腫瘤組織。這些重建後的影像顯示出EPR效應 (Enhanced Permeation and Retention),即是奈米金(橘色部分)優先聚集在腫瘤上。
 圖十三 圖十三
目前在進行奈米解析度的X光斷層影像術的重要限制因素是當執行次細胞成像等級的超高解析度的影像重組時,樣品位置在旋轉時位置的精確度會受到機械精密度及再現性的嚴重影響。但是在進行微米等級的空間解析度的斷層成像與重建時樣品位置精準度就相對不成為問題。對用非單光的X光和沒有波帶片取像影像重組也是相對簡單的,因為數千張的影像可以在幾秒鐘內就擷取到。

圖十四是利用標準背投影濾波方法所拍的小鼠肝臟X光影像重建3D影像, 360張的用於3D重建的X光影像擷取都在10 ms達成。影像重組顯然並不會影響到解析度。
輻射破壞
高速影像擷取可以讓檢體在被輻射嚴重破壞之前得到結果。這一點已經在在先前工作[22]測試過,我們在潮濕狀態下從老鼠大腦和動物細胞中培養且固定的神經元細胞,這個結果可以證實目前的實驗。基本上,我們尚未在目前實驗中的影像擷取發現到偵測得到的輻射破壞。
這個鼓舞的結果並不是那麼全然地令人驚訝,因為相位對比的加強效應,相同品質與效果的影像可以使用較低的輻射劑量取得,因此可以有效降低曝光和輻射效應。然而幅射破壞的風險是一直存在而且不會自動消失的。這個潛在的危機對於要處理大數量的投影影像數據的斷層掃瞄過程尤其明顯,為了使用波帶片放大達到更高的空間影像解析度而使用較長的曝光時間是可能引起可偵測到的幅射破壞。幸運地,仍然有進步的空間,像是使用較好的偵測器[39]可以讓目前每個影像的曝光時間(50 ms)和相對劑量可以減少到一到兩個數量級大小。使用冷凍保存[40]也可以達到相似的效果。
厚樣品
硬X射線顯微鏡具有非破壞性的獨特優勢,對於厚的樣品不需複雜的準備程序即可觀察。我們經過一系列的實際測試結果,證實樣品厚度對空間解析的影響主要是由X光散射造成,衰退極為有限也可以相當準確的評估。在不超過釐米厚度的生物樣品空間解析仍足以解析厚組織的細胞位置。以昆蟲之X光成像而言可以觀察到 ? 400 μm蚊子腹部數微米的細血管。擁有低於1 μm的高解析度及可穿透大於1 mm的穿透深度,而體積敏感度可高於1/109。
這種具有選擇性的功能大大的降低樣品準備的困難性,且容易尋找特定的區域做研究。另外,試片可以被保持在較自然的環境。相反的,一般的顯微鏡技術只能透過薄切技術去解析三維的結構,後而此方法容易遺失一些重要的訊息。
因此,X光顯微術不僅可解析細胞輪廓,更可詳細解析次細胞的結構。如同樣品厚度對白光X光顯微術解析度所造成的影響有限,我們發現使用波帶片,只要樣品厚度小於200 μm,空間解析仍可以達到最佳30 nm 的程度。如前面所示的高解析的X光照片已清楚地顯示經合適減薄及染色的次細胞解析度的三維影像,其解析度經斷層掃瞄後並沒有被減損。因此經由這些例子的解釋,顯示出X光顯微術觀察厚樣品的優點,我們可以定位出腫瘤的位子,且利用金顆粒的分佈作定量的分析。
大厚度的試片確實會降低解析度。以我們的經驗,以偵測次細胞為例,樣品厚度可達數毫米都能維持好的解析度。過於大的樣品,由於X光的散射造成影像模糊,因此會使局部斷層掃瞄重組困難的問題[31,32]。
其他方法的比較與結論
我們的實驗證明高穿透性的硬X光不但可以用來探討動物組織的單一細胞,且可以觀察到次細胞結構。以空間解析為首要目地,影像可以達到30 nm的解析程度。對於不同的研究,利用控制不同的參數可以在時間解析和空間解析間取得平衡點。使用白光及未經波帶片放大的顯微術可以即時觀察活體樣品,其空間解析佳,且空間解析也可低於1 μm。我們的結果顯示X光顯微術可以擴展至生物的研究及生物醫學的研究。為了強調這重點,我們將和其他顯微術做一比較。雖然硬X光顯微術確實擁有獨特的益處,但最好的策略還是要和其他技術搭配。
和一般的光學顯微鏡比較,我們的實驗可達較好的解析度 (< 30 nm)。而且樣品的製備簡單,更重要的是硬X光可以探測厚的樣品。雖然穿透式電子顯微鏡提供較好的解析度,但其也需要較複雜的樣品準備步驟,樣品必須乾燥、經包埋後,利用超薄切割成薄片,這樣的步驟不但複雜且耗時。另外,穿透式電子顯微鏡只能觀察小於l μm厚度的薄樣品且其對比受到限制。一般而言樣品可以大角度的旋轉有助於取影像作斷層掃瞄重組,但薄樣品卻無法達成此目標。穿透式電子顯微鏡也可以利用連續切片及演算重組而獲得厚樣品的三維影像,但Z軸的解析度卻受到約束。我們的硬X射線顯微鏡可以偵測較厚的樣品(300 μm ∼10 mm),比軟X光顯微鏡(< 10 μm)或穿透式電子顯微鏡。但我們不需要經過連續切片便可以偵察整個細胞,多細胞結構(multi-cellular structures) 或動物組織,並以減少訊息的遺失或扭曲。
硬X光在生物研究及生物醫學研究的重要性非常明顯。我們不但討論不同顯微術的利弊,並且在某些方面可以取代它們,譬如穿透式電子顯微鏡在動物組織的研究。硬X光顯微鏡的角色將更進一步的擴展:目前的儀器並未達到理論的極限值,此技術有很大的進展空間,因此我們目前也正在發展更先進的系統。
3.醫學應用
X光顯微術開始發展的一個重要目的即是偵測活體生物體內部的微小結構(如小血管)。傳統X光成像因完全依賴吸收對比,如果想要對體內對X光吸收極少的軟組織成像,則為了提高對比度必須使用對X光具有高吸收性造影劑。這無疑地大幅限制了血管造影技術的進一步發展。
使用了額外的相對比, X光顯微術在對軟物質的成像能力方面有了有很大的改進。我們的實驗結果證明同步輻射所產生的X光非常適合做相對比成像並因而可獲得高品質的血管影像[40]。由於不需要使用單色光,因此訊號強度極高,從而可獲得時間解析度小於1毫秒的即時影像。目前我們所發展的同調X光顯微術已達到可以無需使用造影劑即可即時觀察到活體中的最小可觀察到的微血管的地步。在不同活體動物樣品我們均可觀察到小於10微米尺寸的影像。雖然醫用的核磁共振影像有時可以達到比傳統X光成像更好的影像對比,但是這些方法不能觀測到微米級的細微結構。而對這一尺度細微結構的觀察又是對血管疾病、腫瘤醫學的早期診斷即其發展的研究是非常重要的。
圖十五與圖十六是我們所完成的許多微血管造影影像中比較典型的例子。
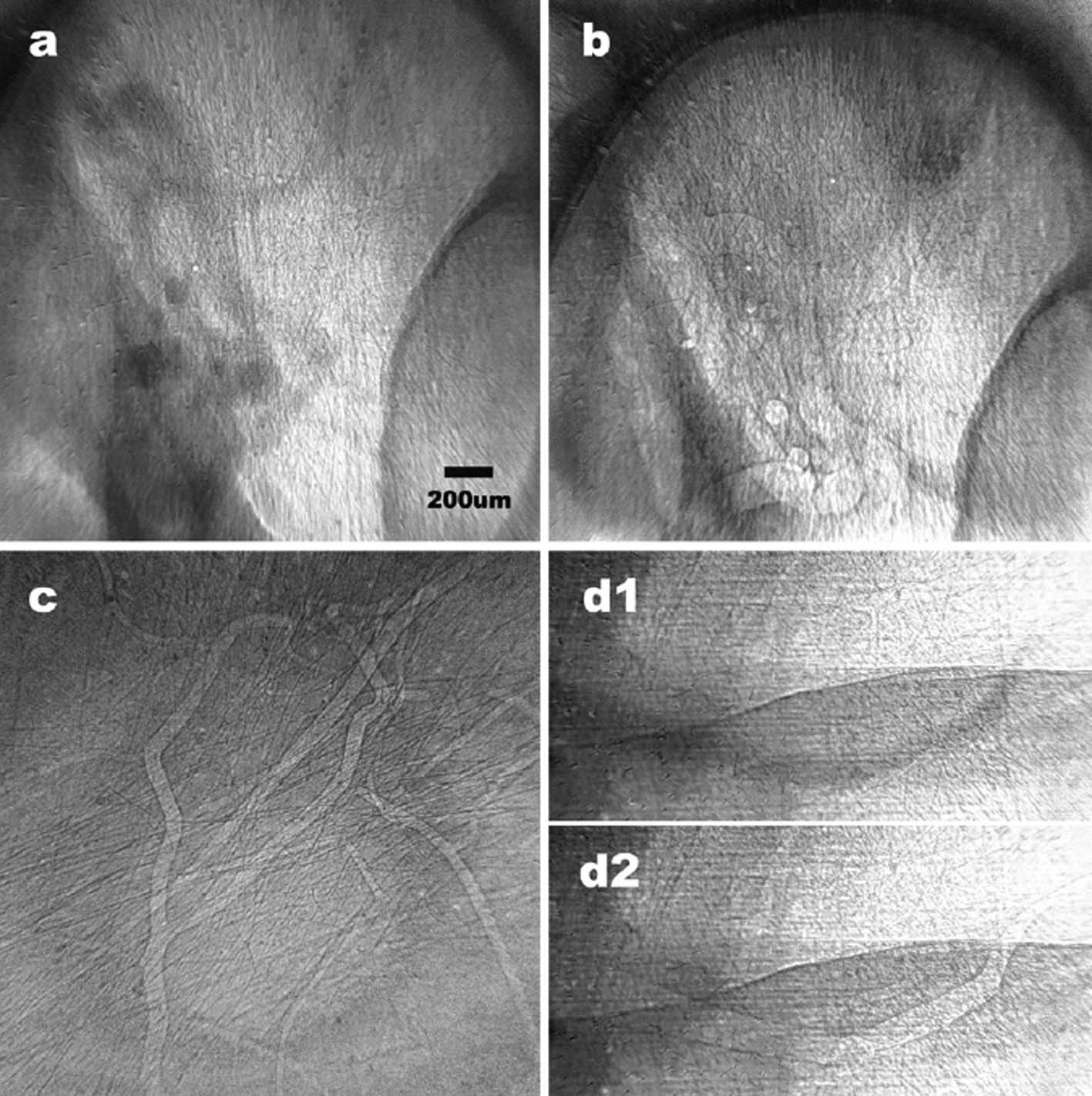
圖十五(a)與(b)中顯示出一隻老鼠眼球內的彎曲放血血管,從微弱可見的混雜的血管中可見脈絡膜血管叢。值得注意的是在圖十五(a)中,少量的並已稀釋一倍的碘對比染色劑在取得影像之前已從預先插入的聚乙稀管內注入頸動脈,因此以這個影像作為參照,我們在確定無顯影劑時所成像的微觀特徵是真正來自是運動中的血管。圖十五(b)是在注入對比染色劑的之前所獲得的影像。這些小血管的血管壁因折射對比的增強效應強化下已經清晰可見。事實上我們可以由這個對比判斷出,這些小血管管壁的影像在沒有對比染劑流過時反而更加清晰,這是血管內強X光吸收與折射增強效應的共同影響的結果。以圖十五(a)而言,在注入對比染色劑後對X光的大量吸收減弱了邊緣增強效應,使得邊緣增強效應產生的折射邊緣幾乎不可見。圖十五(c)與(d)則顯示出寬度約為8到100微米的樹枝狀外耳血管。外耳血管的這種樹枝狀特徵在此之前從未在活體動物影像中取得。圖十五(c) 是在對比染劑流過後之影像。而圖十五(d1)和(d2)則比較了同樣的血管在對比染劑流過期間與流過後的影像。
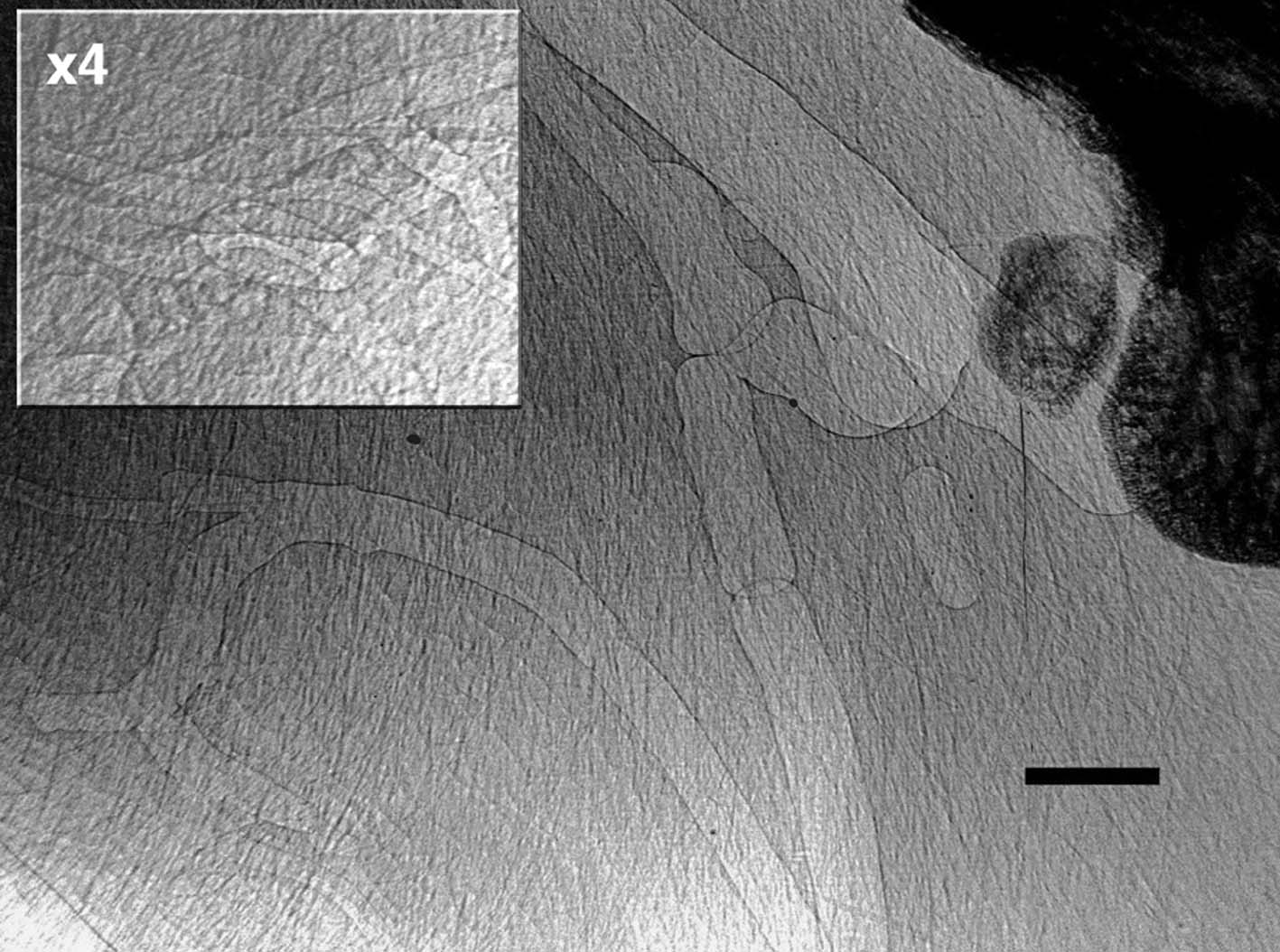
圖十六是在沒有注射任何對比染劑而進行微血管造影很好的一個例子。這個影像清楚的顯示出接近老鼠足踝部位的血管的形態。
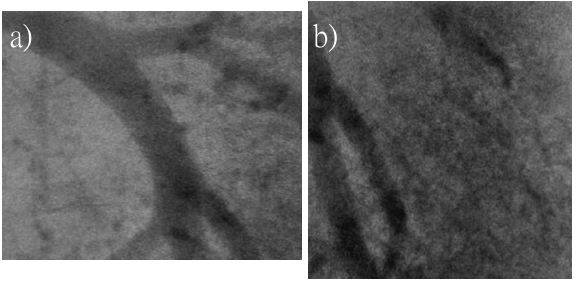
圖十七顯示一隻小鼠心肺器官附近組織結構。圖十七a)的影像是取自一連續影片中,在注射顯影劑後所取得的血管成像,曝光時間1毫秒。圖十七 b) 曝光時間也是1毫秒,小鼠肺臟內之血管結構清晰可見。這個例子顯示要在一個快速運動的系統(以顯微術觀察之極小尺度而言,幾乎所有的活體運動皆相當快速)中,要得到清晰的影像,快速的成像速度的確是必要的,因此同步幅射白光的使用對於獲得這類動態影像來說是不可或缺的。
五、結論
本文描述了有關即時同步輻射X光顯微成像研究的技術及其在生命科學及醫學應用研究的一些實驗結果。這些結果清楚的顯示使用同步輻射X光光源的顯微技術已經快速的發展成熟,而這樣一個具有次毫秒時間及奈米級空間解析度的技術也可以廣泛的使用於許多不同的研究系統,特別是對活體生物進行即時影像觀察或是厚樣品內奈米結構的三度空間成像。我們的實驗結果也顯示利用全景X光顯微鏡可對組織之細胞內部結構作一深入之觀察及探討,研究的核心乃基於三個主要之因素:同調(同步輻射)X光的使用、應用複數折射係數的實數部所貢獻之相對比機制、以及使用具放大效果之菲涅爾波帶片。利用菲涅爾波帶片的X光成像技術可獲得高品質的人類及小鼠細胞之顯微X光影像,Rayleigh空間解析度可達到29奈米,利用影像重組技術也可繼續應用於觀察次細胞特徵的三維空間結構,在生物醫學應用上與其他生物影像設備相比較, 全景X光顯微術在細胞與次細胞結構觀察上將提供更具發展之潛力。目前X光顯微技術發展尚未達到極限,也顯示出未來在技術發展及應用仍有十分有趣的挑戰。
圖說:
圖一:說明X光成像在物體影像邊緣所形成的不同效應的示意圖。
圖二:X光成像在物體(樣品為一塑膠線)實際影像在不同成像距離,所得到折射(上圖)與繞射(下圖)的邊緣效應。
圖三:本實驗室製備之最外圈線寬小於25 nm的波帶片,由掃瞄式電子顯微鏡在不同放大倍率所取得的影像,顯示出25 nm的最小線寬。
圖四:穿透式波帶片取景式X光顯微鏡的光學組成的示意圖。
圖五:位於新竹同步輻射研究中心光源的X光顯微鏡光束線(BL01A超導移頻磁鐵光束線)的略圖。
圖六:寬頻白光條件下利用相對比X光成像技術所取得的孤挺花葉子的X光顯微影像。
圖七:人工培養且被固定住的老鼠腦部的神經元細胞的X光顯微影像。不僅神經元軀體可以輕易的被觀察到,互相連結的神經細胞軸突也可以被觀察到。
圖八:使用硬X光波帶片穿透式全景顯微鏡測試由西門子公司所設計、Xradia公司所生產的標準氮化矽薄膜上製作的金星狀圖案測試片。所取得的X光顯微影像顯示出此測試圖樣最小線寬為30 nm,而不同線寬的間距為60 nm。透過上述的Rayleigh-criterion計算其空間解析度優於30 nm。
圖九:為本實驗室製作的奈米測試圖案,最小線寬為20 nm。
圖十:A)利用非單光X光顯微術,藉由使用鎳增強效果的DAB染色,可以清楚地觀察到HeLa 細胞內網狀分布的相對比影像。
圖十一:使用硬X光波帶片穿透式全景顯微鏡測試EMT-6細胞經過免疫染色的測試結果,很清楚可以看到這個方法可以重現細胞骨架的三維立體結構,圖十一b)是圖十一a)的X光斷層掃描重建的影像。
圖十二:是同樣檢體的有限角度的影像重組,與奈米金粒子一起培養的EMT-6細胞。如圖十二a)和十二b)所示,細胞核附近叢集的金粒子可以被個別的解析出來。
圖十三:是200 μm厚的含有奈米金的腫瘤組織的X光影像。這些重建後的影像顯示出EPR效應 (Enhanced Permeation and Retention),即是奈米金(橘色部分)優先聚集在腫瘤上。
圖十四:是利用標準背投影濾波方法所拍的小鼠肝臟X光影像重建3D影像, 360張用於3D重建的X光影像擷取都在10 ms達成。影像重組顯然並不會影響到解析度。
圖十五: (a)與(b)中顯示出一隻老鼠眼球內的彎曲放血血管,從微弱可見的混雜的血管中可見脈絡膜血管叢。(b)是在注入對比染色劑的之前所獲得的影像。這些小血管的血管壁因折射對比的增強效應強化下已經清晰可見。以圖十五(a)而言,在注入對比染色劑後的對X光的大量吸收減弱了邊緣增強效應,使得邊緣增強效應產生的折射邊緣幾乎不可見。圖十五(c)與(d)則顯示出寬度約為8到100微米的樹枝狀外耳血管。外耳血管的這種樹枝狀特徵在此之前從未在活體動物影像中取得。圖十五(c) 是在對比染劑流過後之影像。而圖十五(d1)和(d2)則比較了同樣的血管在對比染劑流過期間與流過後的影像。
圖十六:是在沒有注射任何對比染劑而進行微血管造影很好的一個例子。這個影像清楚的顯示出接近老鼠足踝部位的血管的形態。
圖十七:顯示一隻小鼠心肺器官附近組織結構。圖十七a)的影像是取自一連續影片中,在注射顯影劑後所取的的血管成像,曝光時間1毫秒。圖十七b) 曝光時間也是1毫秒,小鼠肺臟內之血管結構清晰可見。
參考文獻
-
W. C. Rontgen, Nature 53, 274 (1896).
- G. Margaritondo and R. Meuli, European Radiology 13, 2633 (2004).
- R. Meuli, Y. Hwu, J. H. He and G. Margaritondo, European Radiology 14, 1550 (2004).
- G. Margaritondo, Introduction to Synchrotron Radiation, New York: Oxford (1988).
- G. Margaritondo, Elements of Synchrotron Radiation for Chemistry, Biology and Medical Research, New York: Oxford (2003).
- F. Arfelli, M. Assante, V. Bonvicini, A. Bravin, G. Cantatore, E. Castelli, L. Dalla Palma, M. Di Michiel, R. Longo, A. Olivo, S. Pani, D. Pontani, P. Poropat, P. Prest, A. Rashevsky, G. Tromba, A. Vacchi, E. Vallazza and F. Zanconati, Physics Medicine and Biology 43, 2845 (1998).
- F. Arfelli, V. Bonvicini, A. Bravin, G. Cantatore, E. Castelli, L. Dalla Palma, M. Di Michiel, M. Fabrizioli, R. Longo, R. H. Menk, A. Olivo, S. Pani, D. Pontani, P. Poropat, P. Prest, A. Rashevsky, M. Ratti, L. Rigon, G. Tromba, A. Vacchi, E. Vallazza and F. Zanconati, Radiology 215, 286(2000).
- A. Snigirev, I. Snigireva, V. Kohn, S. Kuznetsov and I. Schelokov, Rev. Sci. Instrum. 66, 5486 (1995).
- D. Chapman, W. Thomlinson, R. E. Johnston, D. Washburn, E. Pisano, N. Gmur, Z. Zhong, R. Menk, F. Arfelli and D. Dayers, Phys. Med. Biol. 42, 2015 (1997).
- A. Pogany, D. Gao and S. W. Wilkins, Rev. Sci. Instrum. 68, 2774 (1997).
- S. W. Kilkins, T. E. Gureyev, D. Gao, A. Pogany and A. W. Stevenson, Nature 384, 335 (1996).
- K. A. Nugent, T. E. Gureyev, D. F. Cookson, D. Paganin and Z. Barnea, Phys. Rev. Lett. 77, 2961 (1996).
- P. Cloetens, M. Pateyron-Salome, Y. Buffiere, G. Peix, J. Baruchel, F. Peyrin F and M. Schlenker, J. Appl. Phys. 81, 5878 (1997).
- G. Margaritondo and G. Tromba, J. Appl. Phys. 85, 3406 (1999).
- Y. Hwu, H. H. Hsieh, M. J. Lu, W. L. Tsai, H. M. Lin, W. C. Goh, B. Lai, J. H. Je, C. K. Kim, D. Y. Noh, H. S. Youn, G. Tromba and G. Margaritondo, J. Appl. Phys. 86, 4613 (1999).
- Y. Hwu, W. L. Tsai, H. M. Chang, H. I. Yeh, P. C. Hsu, Y. Cu. Yang, Y. T. Su, H. L. Tsai, G. M. Chow, P. C. Ho, S. C. Li, H. O. Moser, P. Yang, S. K. Seol, C. C. Kim, J. H. Je, E. Stefanekova, A. Groso and G. Margaritondo, Biophysics. J. 87, 4180 (2004).
- C. K. Gary, H. Park, L. W. Lombardo, M. A. Piestrup, J. T. Cremer, R. H. Pantell, and Y. I. Dudchik, Appl. Phys. Lett. 90, 181111 (2007).
- C. G. Schroer, J. Meyer, M. Kuhlmann, B. Benner, T. F. Günzler, B. Lengeler, C. Rau, T. Weitkamp, A. Snigirev, and I. Snigireva, Appl. Phys. Lett. 81, 1527 (2002)
- T. Wilhein, B. Kaulich, E. Di Fabrizio, F. Romanato, S. Cabrini, and J. Susini, Appl. Phys. Lett. 78, 2082 (2001)
- B. Kaulich, S. Oestreich, M. Salome, R. Barrett, J. Susini, T. Wilhein, E. Di Fabrizio, M. Gentili, and P. Charalambous, Appl. Phys. Lett. 75, 4061 (1999)
- J. Kirz, H. Ade, E. Anderson, C. Buckley, H. Chapman, M. Howells, C. Jacobsen, C. H. Ko, S. Lindaas, D. Sayre, et al. Nucl. Instrum. Methods. 87, 92 (1994).
- C. Jacobsen, T. Beetz, M. Feser, A. Osanna, A. Stein, and S. Wirick, Surf. Rev. Lett. 9, 185 (2002).
- C.-A. Larabell, D. Yager, and W. Meyer-Ilse, Proc. of the 6th X-Ray Microscopy Conference, American Institute of Physics, College Park, MD. 507, 107 (2000).
- T. Ford, W. Meyer-Ilse, and A. D. Stead, Proc. of the 6th X-Ray Microscopy Conference, American Institute of Physics, College Park, MD. 507, 119 (2000).
- D. Weis, G. Schneider, B. Niemann, P. Guttmann, D. Rudolph, and G. Schmahl, Proc. of the 6th X-Ray Microscopy Conference, American Institute of Physics, College Park, MD. 507, 123 (2000).
- W. Yun, B. Lai, A. Krasnoperova, E. Di Fabrizio, Z. Cai, F. Cerrina, Z. Chen, M. Gentili, and E. Gluskin, Rev. Sci. Instrum. 70, 3537 (1999).
- D. Attwood, Soft X-Rays and Extreme Ultraviolet Radiation: Principles and Applications, Cambridge: Cambridge University Press, pp 337-394 (1999).
- W. Chao, B. D. Harteneck, J. A. Liddle, E. H. Anderson and D. T. Attwood, Nature, 435, 1210 (2005).
- T. N. Lo, Y. T. Chen, C. W. Chiu, C. J. Liu, S. R. Wu, I. K. Lin, C. I. Su, W. D. Chang, Y. Hwu, B. Y. Shew, C. C. Chiang, J. H. Je, G. Margaritondo, J. Phys. D: Appl. Phys., 40, 3172 (2007).
- Y. S. Chu, J. M. Yi, H. J. Wu, H. C. L. Wang, A. Tkachuk, W. Yun, M. Feser, S. R. Wu, J. Y. Wang, C. C. Chien, Y. Hwu, C. J. Liu, C. H. Wang, F. De Carlo, Q. Shen, W. K. Lee, C. S. Yang, K. S. Liang, J. H. Je, G. Margaritondo, Appl. Phys. Lett. 92, 103119 (2008).
- J.-W. Miao, B. T. Ishikawa, E. H. Johnson, Lai, B. Anderson, and K. O. Hodgson, Phys. Rev. Lett. 89, 088303 (2002).
- J. Miao, K. O. Hodgso, T. Ishikawa, C. A. Larabell, M. A. LeGros, Y. Nishino, Proc Natl. Acad. Sci. U S A. 100, 110 (2003).
- J. W. Miao and T. K. Lee’s work
- W. K. Hsieh, F. R. Chen, J. J. Kai and A. I.Kirkland, Ultramicroscopy 98, 99 (2004).
- G. C. Yin, F. R. Chen, Y. Hwu, H. P. D. Shieh, K. S. Liang, Appl. Phys. Lett. 90,181118 (2007).
- G. C. Yin, Y. F. Song, M. T. Tang, F. R. Chen, K. S. Liang, F. W. Duewer, M. Feser, W. B. Yun and H. P. D. Shieh, Appl. Phys. Lett., 89, 221122 (2006).
- M. Young, J. Opt. Soc. Am. 62, 972 (1972).
- A. Faridani, D. Finch, E. L. Ritman, and K. T. Smith, SIAM J. Appl. Math. 57, 1095 (1997).
- W. Meyer-Ilse, D. Hamamoto, A. Nair, S. A. Lelievre, G. Denbeaux, , L. Johnson, A. L. Pearson, D. Yager, M.A. Legros, and C.A. Larabell, J. Microsc. 201, 395 (2001).
- Y. Hwu, W. L. Tsai, J. H. Je, S. K. Seol, B. Kim, A. Groso, G. Margaritondo, K. H. Lee, and J. K. Seong, Phys. Med. Biol. 49, 501 (2004).
- R. Fitzgerald, Physics Today 53, 4355 (2004).
- W. R. Dix, K. Engelke, W. Graeff, C. Hamm, J. Heuer, B. Kaempf, W. Kupper, M. Lohmann, B. Reime and R. Reumann, Nucl. Instrum. Meth. A 314, 307 (1992).
- Satoshi Takeshita, Takaaki Isshiki, Hidezo Mori, Etsuro Tanaka, Koji Eto, Yoshimichi Miyazawa, Akira Tanaka, Yoshiro Shinozaki, Kazuyuki Hyodo, Masami Ando, Misao Kubota, Kenkichi Tanioka, Keiji Umetani, Masahiko Ochiai, Tomohide Sato, and Hideo Miyashita, Circulation 95, 805 (1997).
- Y. Tanaka, H. Mori, e. Tanaka, S. Abe, H. Makuuchi, H. Nakazawa, S. Handa, K. Tanioka, M. Kubota, S. Jumaoka, T. Hyodo and M. Ando, Medical Applications of synchrotron radiation, M. Ando and C. Uyama eds. Tokyo: Springer-Verlag, (1998).
- H. Mori, E. Tanaka, K. Hyodo, M. M. Uddin, T. Sekka, K. Ito, Y. Shinozaki, A. Tanaka A. H. Nakazawa, S. Abe, S. Handa, M. Kubota, K. Tanioka, K. Umetani and M. Ando, Am. J. Lphysiol. 276, H429 (1999)
|